Разделы сайта
Выбор редакции:
- Уральские рабочие в армии колчака
- Профильные смены в детских лагерях
- История римской империи от начала до конца кратко, годы существования, интересные факты
- Модель Вселеной. Стационарная Вселенная. Размер вселенной Космологическая модель ранней вселенной эра излучения
- Царь — колокол и его плохая карма — интересные факты
- «Очарованный странник Краткое содержание очарованный странник
- Значение слова биосинтез Новый толково-словообразовательный словарь русского языка, Т
- Поэзия бодлера. Бодлер шарль пьер. Стихи и музыка
- Как решать математические ребусы
- Расписание уроков шаблон для заполнения в ворде
Реклама
| Определить тип химической связи. Химическая связь — Гипермаркет знаний |
|
3.3.1 Ковалентная связь – это двухцентровая двухэлектронная связь, образующаяся за счёт перекрывания электронных облаков, несущих неспаренные электроны с антипараллельными спинами. Как правило образуется между атомами одного химического элемента. Количественно она характеризуется валентностью. Валентность элемента – это его способность образовывать определенное число химических связей за счёт свободных электронов, находящихся атомной валентной зоне. Ковалентную связь образует только пара электронов, находящаяся между атомами. Она называется поделенной парой. Остальные пары электронов называют неподеленными парами. Они заполняют оболочки и не принимают участие в связывании. Связь между атомами может осуществляться не только одной, но и двумя и даже тремя поделенными парами. Такие связи называются двойными и тройными - кратными связями. 3.3.1.1 Ковалентная неполярная связь. Связь, осуществляемая за счет образования электронных пар, в одинаковой мере принадлежащих обоим атомам, называется ковалентной неполярной. Она возникает между атомами с практически равной электроотрицательностью (0,4 > ΔЭО > 0) и, следовательно, равномерным распределением электронной плотности между ядрами атомов у гомоядерных молекул. Например, Н 2 , О 2 , N 2 , Cl 2 и т. д. Дипольный момент таких связей равен нулю. Связь СН в предельных углеводородах (например, в СН 4) считается практически неполярной, т.к. Δ ЭО = 2,5 (С) - 2,1 (Н) = 0,4. 3.3.1.2 Ковалентная полярная связь. Если молекула образована двумя разными атомами, то зона перекрывания электронных облаков (орбиталей) смещается в сторону одного из атомов, и такая связь называется полярной . При такой связи вероятность нахождения электронов возле ядра одного из атомов выше. Например, НCl, H 2 S, PH 3 . Полярная (несимметричная) ковалентная связь - связь между атомами с различной электроотрицательностью (2 > ΔЭО > 0.4) и несимметричным распределением общей электронной пары. Как правило, она образуется между двумя неметаллами. Электронная плотность такой связи смещена в сторону более электроотрицательного атома, что приводит к появлению на нем частичного отрицательного заряда (дельта минус), а на менее электроотрицательном атоме - частичного положительного заряда (дельта плюс) C Cl C O C N O H C Mg . Направление смещения электронов обозначается также стрелкой: CCl, CО, CN, ОН, CMg. Чем больше различие в электроотрицательности связываемых атомов, тем выше полярность связи и больше ее дипольный момент. Между противоположными по знаку частичными зарядами действуют дополнительные силы притяжения. Поэтому, чем полярнее связь, тем она прочнее. Кроме поляризуемости ковалентная связь обладает свойством насыщаемости – способностью атома образовывать столько ковалентных связей, сколько у него имеется энергетически доступных атомных орбиталей. Третьим свойством ковалентной связи является её направленность. 3.3.2 Ионная связь. Движущей силой ее образования является все то же стремление атомов к октетной оболочке. Но в ряде случаев такая “октетная” оболочка может возникнуть только при передаче электронов от одного атома к другому. Поэтому, как правило, ионная связь образуется между металлом и неметаллом. Рассмотрим в качестве примера реакцию между атомами натрия (3s 1) и фтора (2s 2 3s 5). Разница электроотрицательности в соединении NaF ЭО = 4,0 - 0,93 = 3,07 Натрий, отдав фтору свой 3s 1 -электрон, становится ионом Na + и остается с заполненной 2s 2 2p 6 оболочкой, что отвечает электронной конфигурации атома неона. Точно такую же электронную конфигурацию приобретает фтор, приняв один электрон, отданный натрием. В результате возникают силы электро-статического притяжения между противоположно заряженными ионами. Ионная связь – крайний случай полярной ковалентной связи, основанная на электростатическом притяжении ионов. Такая связь возникает при большой разнице в электроотрицательностях связываемых атомов (ЭО > 2), когда менее электроотрицательный атом почти полностью отдает свои валентные электроны и превращается в катион, а другой, более электроотрицательный атом, эти электроны присоединяет и становится анионом. Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщености. В силу этого иoннaя связь не имеет пространственной направленности и насыщаемости , так как каждый ион связан с определенным числом противоионов (координационное число иона). Поэтому ионно-связанные соединения не имеют молекулярного строения и представляют собой твердые вещества, образующие ионные кристаллические решетки, с высокими температурами плавления и кипения, они высокополярны, часто солеобразны, в водных растворах электропроводны. Например, MgS, NaCl, А 2 O 3 . Соединений с чисто ионными связями практически не существует, поскольку всегда остаётся некоторая доля ковалентности в силу того, что полного перехода одного электрона к другому атому не наблюдается; в самых «ионных» веществах доля ионности связи не превышает 90 %. Например, в NaF поляризация связи составляет около 80 %. В органических соединениях ионные связи встречаются довольно редко, т.к. атом углерода не склонен ни терять, ни приобретать электроны с образованием ионов. Валентность элементов в соединениях с ионными связями очень часто характеризуют степенью окисления , которая, в свою очередь, соответствует величине заряда иона элемента в данном соединении. Степень окисления - это условный заряд, который приобретает атом в результате перераспределения электронной плотности. Количественно она характеризуется числом смещённых электронов от менее электроотри-цательного элемента к более электроотрицательному. Положительно заряженный ион образуется из того элемента, который отдал свои электроны, а отрицательный ион - из элемента, который эти электроны принял. Элемент, находящийся в высшей степени окисления (максимально положительной), уже отдал все свои валентные электроны, находящиеся в АВЗ. А поскольку их количество определяется номером группы, в которой стоит элемент, то высшая степень окисления для большинства элементов и будет равна номеру группы . Что касается низшей степени окисления (максимально отрицательной), то она появляется при формировании восьмиэлектронной оболочки, то есть в том случае, когда АВЗ заполняется полностью. Для неметаллов она рассчитывается по формуле № группы – 8 . Для металлов равна нулю , поскольку они электроны принимать не могут. Например, АВЗ серы имеет вид: 3s 2 3р 4 . Если атом отдаст все электроны (шесть), то приобретёт высшую степень окисления +6 , равную номеру группы VI , если примет два, необходимые для завершения устойчивой оболочки, то приобретёт низшую степень окисления –2 , равную № группы – 8 = 6 – 8= –2. 3.3.3 Металлическая связь. Большинство металлов обладает рядом свойств, имеющих общий характер и отличающихся от свойств других веществ. Такими свойствами являются сравнительно высокие температуры плавления, способность к отражению света, высокая тепло– и электропроводность. Эти особенности объясняются существованием в металлах особого вида взаимодействия – металлической связи. В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов, которые достаточно слабо связаны со своими ядрами и могут легко отрываться от них. В результате этого в кристаллической решетке металла появляются положительно заряженные ионы, локализованные в определенных положениях кристаллической решетки, и большое количество делокализованных (свободных) электронов, сравнительно свободно перемещающихся в поле положительных центров и осуществляющих связь между всеми атомами металла за счёт электростатического притяжения. В этом состоит важное отличие металлических связей от ковалентных, которые имеют строгую направленность в пространстве. Силы связи в металлах не локализованы и не направлены, а свободные электроны, образующие «электронный газ», обусловливают высокую тепло- и электропроводность. Поэтому в этом случае невозможно говорить о направленности связей, так как валентные электроны распределены по кристаллу почти равномерно. Именно этим и объясняется, например, пластичность металлов, т. е. возможность смещения ионов и атомов в любом направлении 3.3.4 Донорно-акцепторная связь. Помимо механизма образования ковалентной связи, согласно которому общая электронная пара возникает при взаимодействии двух электронов, существует также особый донорно-акцепторный механизм . Он заключается в том, что ковалентная связь образуется в результате перехода уже существующей (неподелённой) электронной пары донора (поставщика электронов) в общее пользование донора и акцептора (поставщика свободной атомной орбитали). После образования она ничем не отличается от ковалентной. Донорно-акцепторный механизм хорошо иллюстрируется схемой образования иона аммония (рисунок 9) (звездочками обозначены электроны внешнего уровня атома азота):
Рисунок 9- Схема образования иона аммония Электронная формула АВЗ атома азота 2s 2 2р 3 , то есть он имеет три неспаренных электрона, которые вступают в ковалентную связь с тремя атомами водорода (1s 1), каждый из которых имеет один валентный электрон. При этом образуется молекула аммиака NH 3, в которой сохраняется неподелённая электронная пара азота. Если к этой молекуле подойдёт протон водорода (1s 0), не имеющий электронов, то азот передаст свою пару электронов (донор) на эту атомную орбиталь водорода (акцептор), в результате чего образуется ион аммония. В нём каждый атом водорода связан с атомом азота общей электронной парой, одна из которых реализована по донорно-акцепторному механизму. Важно отметить, что связи Н-N, образованные по различным механизмам, никаких различий в свойствах не имеют. Указанное явление обусловлено тем, что в момент образования связи орбитали 2s– и 2р– электронов атома азота изменяют свою форму. В итоге возникают четыре совершенно одинаковые по форме орбитали. В качестве доноров обычно выступают атомы с большим количеством электронов, но имеющие небольшое число неспаренных электронов. Для элементов II периода такая возможность кроме атома азота имеется у кислорода (две неподеленные пары) и у фтора (три неподеленные пары). Например, ион водорода Н + в водных растворах никогда не бывает в свободном состоянии, так как из молекул воды Н 2 О и иона Н + всегда образуется ион гидроксония Н 3 О + Ион гидроксония присутствует во всех водных растворах, хотя для простоты в написании сохраняется символ H + . 3.3.5 Водородная связь. Атом водорода, связанный с сильно электроотрицательным элементом (азотом, кислородом, фтором и др.), который «стягивает» на себя общую электронную пару, испытывает недостаток электронов и приобретает эффективный положительный заряд. Поэтому он способен взаимодействовать с неподеленной парой электронов другого электроотрицательного атома (который приобретает эффективный отрицательный заряд) этой же (внутримолекулярная связь) или другой молекулы (межмолекулярная связь). В результате возникает водородная связь , которая графически обозначается точками:
Эта связь значительно слабее других химических связей (энергия ее образования 10– 40 кДж/моль) и в основном имеет частично электростатический, частично донорно-акцепторный характер. Исключительно важную роль водородная связь играет в биологических макромолекулах, таких неорганических соединениях как H 2 O, H 2 F 2 , NH 3 . Например, связи О-Н в Н 2 О имеют заметный полярный характер с избытком отрицательного заряда – на атоме кислорода. Атом водорода, наоборот, приобретает небольшой положительный заряд + и может взаимодействовать с неподеленными парами электронов атома кислорода соседней молекулы воды. Взаимодействие между молекулами воды оказывается достаточно сильным, таким, что даже в парах воды присутствуют димеры и тримеры состава (H 2 O) 2 , (Н 2 O) 3 и т. д. В растворах же могут возникать длинные цепи ассоциатов такого вида: поскольку атом кислорода имеет две неподеленные пары электронов. Наличие водородных связей объясняет высокие температуры кипения воды, спиртов, карбоновых кислот. За счет водородных связей вода характеризуется столь высокими по сравнению с H 2 Э (Э = S, Se, Te) температурами плавления и кипения. Если бы водородные связи отсутствовали, то вода плавилась бы при –100 °С, а кипела при –80 °С. Типичные случаи ассоциации наблюдаются для спиртов и органических кислот. Водородные связи могут возникать как между различными молекулами, так и внутри молекулы, если в этой молекуле имеются группы с донорной и акцепторной способностями. Например, именно внутримолекулярные водородные связи играют основную роль в образовании пептидных цепей, которые определяют строение белков. Н-связи влияют на физические и химические свойства вещества. Связи типа водородных не образуют атомы других элементов , поскольку силы электростатического притяжения разноименных концов диполей полярных связей (О-Н, N-H и т.п.) довольно слабы и действуют лишь на малых расстояниях. Водород, обладая наименьшим атомным радиусом, позволяет сблизиться таким диполям настолько, что силы притяжения становятся заметными. Никакой другой элемент с большим атомным радиусом не способен к образованию подобных связей. 3.3.6 Силы межмолекулярного взаимодействия (силы Ван-дер-Ваальса). В 1873 г. голландский ученый И. Ван-дер-Ваальс предположил, что существуют силы, обуславливающие притяжение между молекулами. Эти силы позднее получили название ван-дер-ваальсовых сил – наиболее универсальный вид межмолекулярной связи. Энергия ван-дер-ваальсовой связи меньше водородной и составляет 2–20 кДж/∙моль. В зависимости от способа возникновения силы делятся на: 1) ориентационные (диполь-диполь или ион-диполь) - возникают между полярными молекулами или между ионами и полярными молекулами. При сближении полярных молекул они ориентируются таким образом, чтобы положительная сторона одного диполя была ориентирована к отрицательной стороне другого диполя (рисунок 10).
2) индукционные (диполь – индуцированный диполь или ион– индуцированный диполь) - возникают между полярными молекулами или ионами и неполярными молекулами, но способными к поляризации. Диполи могут воздействовать на неполярные молекулы, превращая их в индицированные (наведенные) диполи. (рисунок 11).
3) дисперсионные (индуцированный диполь – индуцированный диполь) - возникают между неполярными молекулами, способными к поляризации. В любой молекуле или атоме благородного газа возникают флуктуации электрической плотности, в результате чего появляются мгновенные диполи, которые в свою очередь индуцируют мгновенные диполи у соседних молекул. Движение мгновенных диполей становится согласованным, их появление и распад происходит синхронно. В результате взаимодействия мгновенных диполей энергия системы понижается (рисунок 12).
Слово может существовать само по себе. Например, в словарной статье. Однако при использовании слова нужно уметь связывать его с другими словами. Все слова в предложении соединяются между собой по смыслу и грамматически. Такую связь создают союзы, порядок слов, окончания и предлоги. Связь бывает двух видов: сочинительная и подчинительная. Сочинительная связь предполагает соединение равноправных слов: дождь и снег; то мороз, то оттепель. Эта связь нужна для распространения предложения однородными членами: Я сел на пень и стал смотреть на цветы и деревья . Подчинительная связь основана на выделении главного и зависимого слов: большая помощь , сидеть на берегу, прочитал вчера. Так из словосочетаний образуются предложения. Не являются словосочетаниями предлоги со словами: между нами, около школы, напротив аптеки. Ряды однородных членов или обособленные члены предложения, а также грамматическая основа. От подлежащего и сказуемого можно задать вопросы к другим словам. Например, в предложении «На нашей очень шумной по обычным дням улице стояла тишина» есть словосочетания разных типов: согласование (на нашей улице, на шумной улице, по обычным дням), управление (стояла на улице, стояла по дням), примыкание (очень шумной). По главному слову словосочетания бывают глагольными, именными и наречными. По зависимому слову можно определить характер смысловых отношений между словами: определительные (отвечают на вопросы «какой?», «чей?», как определения), объектные (вопросы косвенных падежей, как дополнения), обстоятельственные (вопросы наречий). При согласовании главное и зависимое слова согласуются друг с другом в роде, числе и падеже: мой друг, моего друга, моему другу, о моем друге. Узнать этот вид связи легко, нужно всего-навсего задать вопросы: «какой?», «чей?», «который?». На такие вопросы отвечают чаще всего прилагательные и местоимения, числительные и причастия. Все они зависят от имени существительного: на синем льду , птичий хор , своим пеналом , другой дом , первый раз , решенная задача . При управлении главное слово командует зависимым словом и заставляет его стоять в форме какого-либо падежа. Изменяя главное слово, мы не можем изменить падеж зависимого (думаю – думает – думал – буду думать – думай о себе). По главному слову управление бывает глагольным (иду по тропе) или именным (нежен со мною). Зависимым словом является существительное с предлогом или без него (предложное или беспредложное управление). Вопросы, которые задаем от главного слова, выраженного чаще глаголом, чем существительным, называются вопросами косвенных падежей. Хотя к некоторым словам можно поставить и смысловой вопрос. Но надо помнить, что зависимое слово – это изменяемое слово: писал другу, думает о маме, пение птиц, рассказ писателя, шел к тебе, искать вас, богат озерами, немного книг. Примыкание основано на особых условиях. Зависимое слово примыкает к главному, являясь неизменяемой частью речи, и отвечает на смысловые вопросы (как, где, когда, куда, откуда, зачем, почему). Примыкают наречия (бежать быстро), деепричастия (сидел наклоняясь), неопределенная форма глагола (поехал учиться, желание рисовать), притяжательные местоимения его, ее, их (его ручка ). Итак, если вы хотите без труда определять вид связи в словосочетании, научитесь выделять словосочетания из предложения, быстро находите главное слово, ставьте от него вопрос и обращайте внимание на части речи. Порядок подробного разбора словосочетания
Образец разбора словосочетанияВ маршрутном такси папа молча и задумчиво смотрел в окно, как будто вспоминал детство всего человечества (Ю. Алешковский). 1. В маршрутном такси – главное слово «такси» – имя существительное, словосочетание именное. Зависимое слово «маршрутном» – имя прилагательное. В такси каком? – определительные отношения, оба слова согласуются в роде, числе и падеже – это согласование. 2. Задумчиво смотрел – главное слово «смотрел» – глагол, словосочетание глагольное. Зависимое слово «задумчиво» – наречие. Смотрел как? – обстоятельственные отношения, зависимое примыкает к главному – это примыкание. 3. Вспоминал детство – главное слово «вспоминал» – глагол, словосочетание глагольное. Зависимое слово «детство» – существительное без предлога в Винительном падеже. Вспоминал что? – объектные или дополнительные отношения, главное управляет зависимым словом – это управление. 4. Всего человечества – главное слово «человечества» – имя существительное, словосочетание именное. Зависимое слово «всего» – местоимение. Человечества какого? – определительные отношения, оба слова согласуются в роде, числе и падеже – значит, это согласование. 5. Детство человечества – главное слово «детство» имя существительное, словосочетание именное. Зависимое слово «человечества» – имя существительное без предлога в Родительном падеже. Детство кого? – дополнительные отношения, главное управляет зависимым словом – это управление. ТренировкаВыпишите словосочетания из предложений и определите тип связи. Время до нашего отлёта тянулось долго-долго. Ещё дольше, чем последний день четвёртой четверти. Потом красивая девушка принесла нам минеральную воду и конфетки, которые едят в небе, и опять велела всем пассажирам застегнуть ремни. Посмотрев вдаль, он снова сел в машину, и мы поехали дальше. В глубине дворика стоял небольшой белый дом. К нему вела выложенная из того же самого камня, что и ограда и ступеньки, дорожка. И по обеим сторонам дорожки росли разноцветные розы. Самостоятельная работа "Типы словосочетаний"ВАРИАНТ 1 дома Широко распростёрлись нижние сучья старой ели, а из-под них, как бы напоказ, выбежало на тенистую лужайку целое созвездие красных грибков. 3. Определи тип подчинительной связи: ещё блестели, звенели в вышине, наши голоса, вязал узлы, беспомощные руки, с какого-то времени, так улыбаюсь, совсем невозможно, как-то узнал, её автора. ВАРИАНТ 2 1. Выпиши из предложения все словосочетания и разбери их по образцу: у моего дома (у дома [чьего?] моего) – именное согласование с определительным значением. Лилово-голубые колокольчики качаются на ветерке, и кажется, это они вызванивают прощальную симфонию летних грёз в немом осеннем лесу. 2. Преобразуй словосочетания в синонимические по образцу: платье из ситца – ситцевое платье. Телефонная трубка, металлическая банка, за справочником туриста, диковина города, больно вспоминать, катушки ниток. 3. Определи тип подчинительной связи: едва заметна, улыбаться кому-то, та девушка, чувствую запах, физически приятно, стать свидетелем, отметить про себя, другие люди, их слова, установили летом. ВАРИАНТ 3 1. Выпиши из предложения все словосочетания и разбери их по образцу: у моего дома (у дома [чьего?] моего) – именное согласование с определительным значением. Пройдёт неделя, другая, подует ветерок - и вот уже закружился над землёй золотой, красный, бурый хоровод. 2. Преобразуй словосочетания в синонимические по образцу: платье из ситца – ситцевое платье. В окнах города, европейское платье, рассказал подробно, гнёзда птиц, суп из рыбы, со стеклянным колпаком. 3. Определи тип подчинительной связи: теряя дыхание, привёз из Турции, доныне бережёт, приятель друга, тебя угостить, вытянула из-за печи, моя косыночка, давно было, их работа, очень жалко. ВАРИАНТ 4 1. Выпиши из предложения все словосочетания и разбери их по образцу: у моего дома (у дома [чьего?] моего) – именное согласование с определительным значением. Оказывается, прежде чем взять орех, кедровка легонько стукает по нему клювом и по звуку определяет, пустой он или нет. 2. Преобразуй словосочетания в синонимические по образцу: платье из ситца – ситцевое платье. Телефонными шутками, мышца лица, отцовские коллеги, фото на память, в печной трубе, не без грусти вырвал. 3. Определи тип подчинительной связи: плакать от смеха, все люди, необыкновенно полезный, говорить по-немецки, осыпающейся листвой, вовремя уйти, обещала угостить, с одним рогом, про него говорили, серые глаза. ВАРИАНТ 5 1. Выпиши из предложения все словосочетания и разбери их по образцу: у моего дома (у дома [чьего?] моего) – именное согласование с определительным значением. И чудится мне, что полнится воздух тонким, как паутина, золотым звоном уходящей осени. 2. Преобразуй словосочетания в синонимические по образцу: платье из ситца – ситцевое платье. Гребень петуха, лучи солнца, птица из леса, полосатыми половиками, любовь мамы, заботливо прочистил. 3. Определи тип подчинительной связи: другой для них, хорошо знакомых, после этого открытия, не видна окружающим, пахнет туманом, капли росы, этот хвост, из-за её плеча, сытая корова, очень памятный. ВАРИАНТ 6 1. Выпиши из предложения все словосочетания и разбери их по образцу: у моего дома (у дома [чьего?] моего) – именное согласование с определительным значением. Целые тетеревиные стаи пасутся на каменных осыпях да на галечниках, потихоньку склёвывают мелкие камешки. 2. Преобразуй словосочетания в синонимические по образцу: платье из ситца – ситцевое платье. Стебель мяты, деревянная шкатулка, на бумажной ленте, закатное небо, трудно разглядеть, дом из кирпича. 3. Определи тип подчинительной связи: незадолго до этого, путается теперь, на том берегу, в верхушках леса, вытирая руки, её благоухание, знал его, уверенно пойдёт, бедовый парень, чересчур мало. Фундаментальной основой химической связи явилась теория химического строения А. М. Бутлерова (1861 г.), согласно которой свойства соединений зависят от природы и числа составляющих их частиц и химического строения. Эта теория нашла подтверждение не только для органических, но и неорганических веществ, поэтому ее следует считать фундаментальной теорией химии. Понятие химической связиБольшинство простых веществ и все сложные вещества (соединения) состоят из атомов, определенным образом взаимодействующих друг с другом. Иными словами, между атомами устанавливается химическая связь. Химическая связь - электронный феномен, заключающийся в том, что, по крайней мере, один электрон, находившийся в силовом поле своего ядра, оказывается в силовом поле другого ядра или нескольких ядер одновременно. При образовании химической связи энергия всегда выделяется, т.е. энергия образующейся частицы должна быть меньше суммарной энергии исходных частиц. Под химической связью понимаются различные виды взаимодействий, обуславливающие устойчивое существование двух- и многоатомных соединений: молекул, ионов, кристаллических и иных веществ. К основным чертам химической связи можно отнести:
По своей природе химическая связь представляет собой взаимодействие между положительно заряженными ядрами и отрицательно заряженными электронами, а также электронов друг с другом. Переход электрона от одного атома к другому, в результате чего образуются разноименно заряженные ионы с устойчивыми электронными конфигурациями, между которыми устанавливается электростатическое притяжение, является простейшей моделью ионной связи: X ⇒ X + + e - Y + e - ⇒ Y - X + Y - Параметры химической связиХимическая связь осуществляется s- и p -электронами внешнего и d- электронами предвнешнего слоя. Эта связь характеризуется следующими параметрами:
 Если мы будем сближать два протона, то между ними возникнут силы отталкивания, и о получении устойчивой системы говорить не приходится. Поместим в их поле один электрон. Здесь могут возникнуть два случая. Первый, когда электрон находится между протонами (слева), и второй, когда он располагается за одним из них (справа). В обоих случаях возникают силы притяжения. В первом случае составляющие этих сил (проекции) на ось, проходящую через центры протонов, направлены в противоположные стороны с силами отталкивания (слева) и могут их компенсировать. При этом возникает энергетически устойчивая система. Во втором случае составляющие сил притяжения направлены в разные стороны (справа) и трудно говорить об уравновешивании сил отталкивания между протонами. Отсюда следует, что для возникновения химической связи с образованием молекулы или иона электроны должны находиться преимущественно в межьядерном пространстве. Эта область называется связывающей , т.к. при нахождении там электронов образуется химическая связь. Область, находящаяся за ядрами, называется разрыхляющей , т.к. при попадании в нее электронов химическая связь не образуется. Применив аналогичные рассуждения к молекуле водорода, можно прийти к выводу, что появление второго электрона в связывающей области еще более стабилизирует систему. Следовательно, для образования устойчивой химической связи необходима, по меньшей мере, одна электронная пара. Спины электронов в этом случае должны быть антипараллельны, т.е. направлены в разные стороны. Образование химической связи должно сопровождаться понижением полной энергии системы. Рассмотрим изменение потенциальной энергии системы на примере сближения двух атомов водорода. Когда атомы находятся на очень большом расстоянии друг от друга, они не взаимодействуют и энергия такой системы близка к нулю. По мере их сближения возникают силы притяжения между электроном одного атома и ядром другого и наоборот. Эти силы увеличиваются обратно пропорционально квадрату расстояния между атомами. Энергия системы понижается. По мере сближения атомов начинают играть роль силы отталкивания между их ядрами и электронами. Увеличение сил отталкивания обратно пропорционально уже шестой степени расстояния. Кривая потенциальной энергии проходит через минимум, а затем резко уходит вверх. Расстояние, соответствующее положению минимума на кривой, является равновесным межъядерным расстоянием и определяет длину химической связи. Так как атомы в молекуле участвуют в колебательном движении относительно положения равновесия, расстояние между ними постоянно меняется, т.е. атомы не жестко связаны друг с другом. Равновесное расстояние соответствует при данной температуре некоторому усредненному значению. С повышением температуры амплитуда колебания увеличивается. При какой-то достаточно большой температуре атомы могут разлететься на бесконечно большое расстояние друг от друга, что будет соответствовать разрыву химической связи. Глубина минимума по оси энергии определяет энергию химической связи, а величина этой энергии, взятая с обратным знаком, будет равна энергии диссоциации данной двухатомной частицы. Если сближаются атомы водорода, электроны которых имеют параллельные спины, между атомами возникают лишь силы отталкивания, а потенциальная энергия такой системы будет возрастать. Количество энергии, выделяющееся при образовании химической связи, называется энергией химической связи Е св . Она имеет единицу измерения [кДж/моль]. Для многоатомных соединений с однотипными связями за энергию связи принимается среднее ее значение, рассчитанное делением энергии образования соединения из атомов на число связей. Например, энергию связи в метане определяют путем деления энергии образования молекулы СН 4 из атомов водорода и углерода на четыре (1640: 4 = 410 кДж/моль). Чем больше энергия химической связи, тем устойчивее молекулы. Например, молекула HF устойчивее молекулы НВr . Важной характеристикой химической связи является ее длина l св , равная расстоянию между ядрами в соединении. Она зависит от размеров электронных оболочек и степени их перекрывания. Имеется определенная корреляция между длиной и энергией связи: с уменьшением длины связи обычно растет энергия связи и соответственно устойчивость молекул . Например, в ряду галогеноводородов от HF до HI длина связи растет, а ее энергия уменьшается. Энергии и длины некоторых химических связей
Виды химической связи  В образовании химической связи участвуют s- , р- и d -электроны, имеющие различную геометрическую конфигурацию электронных облаков и различные знаки волновых функций в пространстве. Для возникновения химической связи необходимо перекрывание частей электронных оболочек с одинаковым знаком волновой функции. В противном случае химическая связь не образуется. Это утверждение легко объяснить на примере наложения двух синусоид, которые в первом приближении могут отождествляться с волновыми функциями. В случае наложения двух синусоид с разными знаками в одной и той же области (слева) суммарная составляющая их будет равна нулю - связи нет. В противоположном случае происходит сложение амплитуд колебаний и образуется новая синусоида - химическая связь образовалась (справа). В зависимости от симметрии электронных облаков, в результате перекрывания которых образуется химическая связь, суммарное электронное облако будет иметь различную симметрию, в соответствии с которой они распадаются на три вида: σ -, π - и δ -связи. 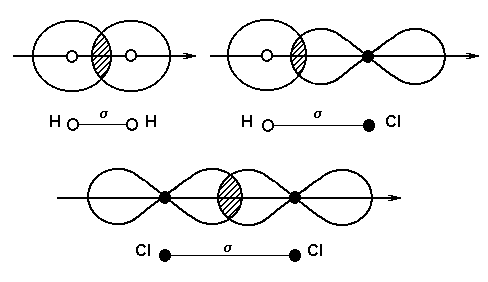 σ-связь осуществляется при перекрывании облаков вдоль линии, соединяющей центры атомов, при этом максимальная электронная плотность достигается в межъядерном пространстве и имеет цилиндрическую симметрию относительно линии, соединяющей центры атомов. В образовании σ -связи в силу своей шаровой симметрии всегда принимают участие s -электроны. Они образуют σ -связь в результате перекрывания со следующими электронами другого атома: s- , р х -, d x 2 -y 2 -электронами. С электронами, находящимися на других орбиталях, например, р у или р x , возникновение химической связи невозможно, так как происходит перекрывание в областях, где электронная плотность имеет противоположные знаки. Возможность образования σ -связи s -электронами не исчерпывается, она может образоваться в случае перекрывания и других электронных облаков, таких, как двух р х или р х и d x 2 -y 2 .  π-связи возникают при перекрывании электронных облаков над и под линией, соединяющей центры атомов. Суммарные электронные облака также симметрично расположены относительно этой оси, но они не имеют цилиндрической симметрии, как в случае σ -связи. В силу своего пространственного расположения π -связь образуют электроны на таких парах орбиталей как р y -р y ,р z -р z ,р y -d xy . δ-связь образуют только d -электроны за счет перекрывания всех четырех своих лепестков электронных облаков, расположенных в параллельных плоскостях. Такое возможно, когда в образовании связи участвуют d xy -d xy , d xz -d xz , d yz -d yz -электроны. Существует и другой подход к классификации химической связи, основанный на характере распределения электронной плотности между атомами в молекуле, т.е. химическая связь рассматривается с точки зрения принадлежности электронной пары тому или иному атому. Возможны три случая:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Читайте: |
|---|
Популярное:
Новое
- Профильные смены в детских лагерях
- История римской империи от начала до конца кратко, годы существования, интересные факты
- Модель Вселеной. Стационарная Вселенная. Размер вселенной Космологическая модель ранней вселенной эра излучения
- Царь — колокол и его плохая карма — интересные факты
- «Очарованный странник Краткое содержание очарованный странник
- Значение слова биосинтез Новый толково-словообразовательный словарь русского языка, Т
- Поэзия бодлера. Бодлер шарль пьер. Стихи и музыка
- Как решать математические ребусы
- Расписание уроков шаблон для заполнения в ворде
- Евгений Евтушенко - биография, личная жизнь, жёны, дети поэта





















 Ca 2+ :
1s 2 2s 2 p 6 3s
2
p
6
Ca 2+ :
1s 2 2s 2 p 6 3s
2
p
6
 Cl – :
1s 2 2s 2 p 6 3s
2
p
6
Cl – :
1s 2 2s 2 p 6 3s
2
p
6